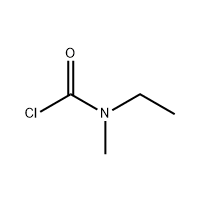
aċidu 3′-Amino-2′-idrossi-[1,1'-bifeni]-3-karboxiliku
aċidu 3′-Amino-2′-idrossi-[1,1'-bifeni]-3-karboxiliku
L-aċidu 3'-Amino-2'-hydroxy-[1,1'-bipheny]-3-carboxylic huwa użat bħala l-intermedjarju ta 'Eltrombopag.
Eltrombopag, żviluppat minn GlaxoSmithKline (GSK) fir-Renju Unit u aktar tard żviluppat b'mod konġunt ma 'Novartis fl-Isvizzera, huwa l-ewwel u l-uniku agonist tar-riċettur ta' molekula żgħira mhux peptide TPO approvat fid-dinja.Eltrombopag ġie approvat mill-FDA tal-Istati Uniti fl-2008 għat-trattament ta 'purpura tromboċitopenika idjopatika (ITP), u fl-2014 għat-trattament ta' anemija aplastika severa (AA).Hija wkoll l-ewwel mediċina approvata mill-FDA tal-Istati Uniti għat-trattament tal-AA f'dawn l-aħħar 30 sena.
F'diċembru 2012, l-FDA tal-Istati Uniti approvat Eltrombopag għat-trattament ta 'tromboċitopenja f'pazjenti b'epatite C kronika (CHC), sabiex pazjenti b'epatite Ċ bi pronjosi ħażina minħabba għadd baxx ta' plejtlits jistgħu jibdew u jżommu terapija standard ibbażata fuq interferon għal mard tal-fwied.Fit-3 ta 'frar 2014, GlaxoSmithKline ħabbret li l-FDA tat il-kwalifika ta' mediċina ta 'trattament rivoluzzjonarju ta' Eltrombopag għat-trattament ta 'emopenja f'pazjenti b'anemija aplastika severa ta' chemicalbook (SAA) li ma rrispondewx bis-sħiħ għall-immunoterapija.Fl-24 ta 'Awwissu 2015, l-FDA tal-Istati Uniti approvat Eltrombopag għat-trattament ta' tromboċitopenja f'adulti u tfal ta 'sena 1 jew aktar bi tromboċitopenja immuni kronika (ITP) li għandhom rispons insuffiċjenti għal kortikosterojdi, immunoglobulini jew splenectomy.Fuq january4,2018, Eltrombopag ġie approvat biex jiġi elenkat fiċ-Ċina għat-trattament ta 'tromboċitopenja immuni primarja (ITP).


![3′-Amino-2′-hydroxy-[1,1'-bipheny]-3-carboxylic acid Image Dehru](http://cdn.globalso.com/jindunchem-med/image351.png)
![aċidu 3′-Amino-2′-idrossi-[1,1'-bifeni]-3-karboxiliku](http://cdn.globalso.com/jindunchem-med/image351-300x300.png)
![6-tetra-O-acteyl-1-C-[4-chloro-3-[[4-[[(3S)-tetrahydrofu-ran-3-il]ossi]fenil]](http://cdn.globalso.com/jindunchem-med/0ecf55f0-300x300.jpg)